原文:https://www.cmde.org.cn/splt/ltwz/ltqt/20190311085808349.html
发布时间:2019-03-08
版权归属原文(原创 2019-03-08 CMDE 中国器审)
一、概述
2018年8月21日,国家药品监督管理局与中国生物材料学会在京联合召开医疗器械监管科学研讨会。与会专家一致认为,开展系统的监管科学研究,建立医疗器械监管科学体系,对于完善规范、高效、高水准监管,推动监管事业可持续发展意义重大[1]。当前国家药品监督管理局医疗器械监管有关部门将策划并组织开展医疗器械监管科学相关的体系建设及项目研究。
上述背景下,本文就监管科学的主要工具和原则进行简要论述。在监管过程中,监管内容、程序、方法和结果处理等内容的确定到底有没有基本的科学原则?监管是否取得预期的良好效果等等?这就是监管科学要回答的问题。监管科学的核心内容是判断监管所依据的科学信息的正确性和可靠性。
为此,Moghissi 等美国监管科学研究所Institute for Regulatory Science(IRS)的专家提出了以下两个概念:“Best Available Regulatory Science (BARS)”以及由此演化的概念“Metrics for Evaluation of Regulatory Scientific Claims(MERSC)”。笔者没有找到关于它的权威翻译,BARS暂且直译为 “最适用且优化的监管科学”、MERSC意译为“监管科学主张的评价方法”。它们是监管科学的主要工具。BARS及MERSC示意图见图1,直观地列举了RARS的五个原则,MERSC 的三个工具,它们是评判监管过程所依据的科学主张的正确性和可靠性的原则、工具和方法。
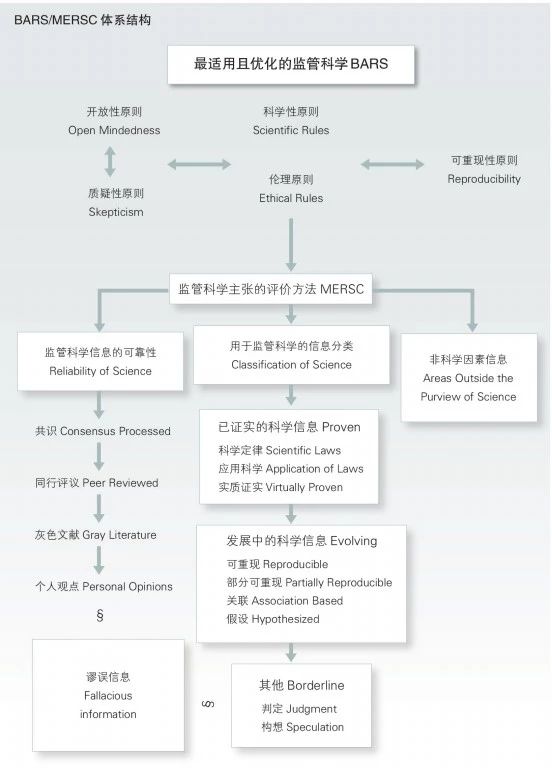
图1 BARS/MERSC体系结构(本文作者对一些条目增加了帮助理解的文字)
应用该系统时,有它一套模型和量化方法。下文只介绍BARS主要原则和MERSC的工具[2]。
二、BARS的五个主要原则[3]
开放性原则:这一原则意味着监管机构愿意接受新知识并利用新知识仔细评估已有的监管主张。历史证据表明许多错误是由于权威、神权、个别科学家和其他人拒绝接受新出现的科学合理的观点而导致的。
质疑性原则:这一原则要求那些作出科学主张的人有义务提供足够的证据来支持他们的主张。质疑性原则确保了开放性原则不被滥用。
科学性原则:所有的学科都使用确定的方法、过程和技术以实施专业活动。例如所有学科在取样、分析、数据报道时都使用到计算方法和统计学规律。
伦理原则:这一原则包括道德、真实、透明三个要素。公众不能理解政策规章背后复杂的科学知识,监管机构有责任以通俗易懂的文字将信息对公众进行披露。
可重现性原则:科学主张正确性的最终评价原则是能否被其他具有资质、能力、必要设备及工具的人或机构重现。可重现性是评价监管科学是否正确的证明。
三、MERSC的三个工具[3]
(一)用于监管科学的科学信息分类标准
这一工具基于科学信息的科学性及严密性进行了类别划分。
1.已证实的科学信息
包括经过验证科学定律或科学原理、应用科学、实质证实科学。科学定律被公众确认并广泛接受,任何具备能力及条件的人都可以重复验证科学定律,科学定律不需要额外的假设或附加条件。应用科学是科学原理在经济、工业等领域的应用,大部分工程学及应用学科均属于应用科学。实质证实科学,对这类科学信息的正确性没有争议,但缺乏全面直接的证据,例如广义及狭义相对论,目前没有可信的数据来反驳它,也没有其他的理论来来替代它解释有关科学现象。
2.发展中的科学信息
几乎所有学科中绝大部分的科技进步都属于发展中的科学信息,按照可重现性是否经过验证及可重现的程度,分为可重现的信息、部分可重现的信息、基于科学定律的关联信息、未充分验证的假设。很多伟大的科学发现开始于未经充分验证的假设,逐渐与科学定律建立关联并不断完善,最后实现可重现。
3.其他信息
不属于已证实的或发展中的科学信息,属于判定与构想。有时候做出的决策或提供给公众的信息缺乏科学基础,但是涉及的具体问题事先咨询了许多专家的意见,这样的信息属于有根据的判定。构想源于个人的直觉,用以发起一项研究或讨论。
4.谬误的信息
与前述的三类信息都不一致,有时被称为伪科学、垃圾科学或具有倾向性的受政治等因素影响加工后的信息。
(二)科学信息的可靠性评价
这一评价工具涉及个人观点、灰色文献、同行评议和共识科学信息。个人观点(personal opinions)是单个人发表的见解,与其经历、教育、社会地位无关,很少作为最适用且优化的科学(BAS),多用来发起一项科学议题。灰色文献(gray literature)就是政府机构、倡导组织和其他没有参与同行评议的人或组织撰写的书面材料,通常是个别组织或个人撰写的观点。这种信息的可信性及质量难以确定,可能包含科学信息,也可能包含谬误信息,这是政府机构、倡导组织和个人在推荐某观点时最常采用的方式。同行评议(peer reviewed),评议人必须与研究的作者等同且没有利益关系或冲突,且研究者应对评议人的批评意见作出积极回应。共识(consensus processed)的形成为解决科学纷争提供了机会,同样形成共识的专业也与研究者相互独立。
(三)非科学因素的信息
BAS涉及科学信息的分类及判定,不包括信念、观念、社会宗旨、信仰、社会及政治诉求等相关信息。众所周知,在科学研究过程中参杂政治社会目的会危害科学判断的客观性和正确性。
非科学因素的信息对监管过程造成不利影响的案例很多。例如[4]:2004年,美国制造商(ReGen Biologics, Inc. of Hackensack, New Jersey)向FDA报批由牛胶原制备的修复膝关节半月板的植入产品,该产品按照510(k)程序,若经论证与市售产品相比实质等同性,则可免于临床试验。制造商声称产品和牛胶原制造的肩关节植入体等同,评审专家两次否决了这一说法,认为两者受力不一样,不具有等同性。制造商所在州三位议员出面干预审评,他们给FDA主任写信请求予以关注。随后不久,FDA主任会见了制造商。后续审评过程中FDA选择了外围专家进行评审,这些外围专家主要来自FDA外围专家库的运动医学医生,制造商还申请回避了原审评专家。2008年12月,FDA按照510(k)程序准予该产品上市,并称专家“明确同意”。这个案例中,FDA官员干预了医疗器械产品的审评审批过程,推翻了原FDA专家的反对意见。
四、结语
随着社会上核能风险、农药使用、废物处理、矿采安全、化学物排放等问题越来越突出,政府监管部门比以往更需要预判新的法律、即将实施的规章、相关行政诉讼案件应对是否合理,预期将会带来怎样的影响和结果。而为了将这些预测的过程变得具有实际可操作性,需要使用一个重要的工具,那就是监管科学。本文中介绍的“最适用且优化的监管科学”(BARS)与“监管科学主张的评价方法”(MERSC)是针对各个行业监管科学的通用方法。具体到医疗器械的监管科学,监管机构所面临的是一系列公共卫生方面的挑战,包括科技迅猛发展带来的产品创新、相关领域的知识和研究方法的爆炸式增长以及全球化等问题。为了迎接这些与过去相比更加复杂的挑战,我国医疗器械监管机构需要在通用理论基础上进行顶层设计及系统规划,结合数十年来医疗器械的监管经验形成具有中国特色的医疗器械监管科学发展战略,探索适合医疗器械监管科学的工具和原则。
参考文献:
[1]医疗器械监管科学研讨会在京召开 (http://www.nmpa.gov.cn/WS04/CL2056/329959.html)
[2] A. Alan Moghissi, Richard A. Calderone, Dennis K. McBride, Lisa Jaeger. Innovation in Regulatory Science: Metrics for Evaluation of Regulatory Science Claims Based on Best Available Regulatory Science. Journal of Regulatory Science, 2017, 05:50
[3] Institute for Regulatory Science (http://nars.org/information/)
[4] FDA Medical Device Approval Based on Politics, Not Science
(https://www.ucsusa.org/our-work/center-science-and-democracy/promoting-scientific-integrity/fda-medical-device-approval.html#.WvcKI0xuKqk)
审评三部 刘文博 史新立 供稿

评论区