原文:https://www.cmde.org.cn/splt/ltwz/lttwyq/20211022090600268.html
发布时间:2021-10-22
版权归属原文(原创 2021-10-21 CMDE 中国器审)
目前基于大规模平行测序的高通量测序技术发展迅猛。不同于大多数体外诊断技术只能检测到单一或确定的几个指标来诊断一种或几种特定的疾病状态,高通量测序技术(Next Generation Sequencing,下文简称NGS)能够检测到人类基因组中超过30亿个碱基,并由此识别出个体可能拥有的大约300万种遗传变异。目前主要应用于无创产前筛查、胚胎植入前遗传学检测、肿瘤基因突变和遗传病等临床检测项目。其检测具有数据量高、通量大、分析复杂等特点。
目前测序行业大规模应用的高通量测序测序仪主要来源于Illumina、Life Technologies和华大基因。2005年第一台Roche 454 Genome Sequencer 20面世,同时Illumina和Life Technologies也推出了各自的不同原理的测序平台,之后两家公司不断推出了的一系列测序仪。Illumina于2010年推出了Hiseq系列,2011年推出台式测序平台Miseq,2014年发布了NextSeq 550,2016年推出了MiniSeq,2017年发布可扩展的NovaSeq系列。同时Life Technologies也推出了Ion PGM、Ion Proton及Ion GeneStudio S5系列。华大基因也在基于Ion Torrent平台的 BGISEQ-100与基于CG平台的BGISEQ-1000后,于2015年推出集成性的Revolocity测序仪和基于联合探针锚定聚合技术与改进的DNA纳米球原理的BGISEQ-500,并在2018年推出数据通量达到6TB的DNBSEQ-T7。测序平台日新月异,10余年内,产品更加成熟,有集成一体的也有小型台式机型,错误率不断下降,测序通量不断提高,由原先的MB的通量发展到TB水平。测序技术飞速发展,也推动监管技术不断发展。
一.FDA的管理方式
从2011年,美国FDA开始研究NGS的评价,参与了科学界制定的相关的标准工作,建立“下一代序列:临床检测标准化”工作组,并开展了一系列的研讨会。
FDA将临床用高通量基因测序仪作为二类(特别控制)医疗器械管理。于2013年批准了第一个基于Miseq Dx基因测序仪的两个针对囊性纤维化的NGS产品。产品评估的重点是如何使用有代表性的变异来评估仪器的分析性能,以及使用聚合的公共数据来支持检测基因中变异的临床相关性。
虽然仪器应该能够准确和可靠地检测基因组序列中可能存在的每一个可能突变,但要求提供这样的数据是不可行的,因此使用不同序列不同突变类型的代表性变异数据集来证明了Miseq Dx的分析测试性能,证明该变异数据集具有充分的分析性能,合理保证测试能够成功识别基因组中的相关变异,而不需要申请人提交测试可能识别的每一种可能变异的数据。
FDA把基因测序产品定义为在特定NGS仪器(如Miseq Dx)上执行的人类DNA测序分析,其工作流程由标准操作程序定义,其中指定了所有材料和程序。因此,对基因测序仪的管理也采用新的监管方法,将测序仪、试剂及软件整合作为整体来进行批准,并对测序仪要求进行标签清单的特殊控制管理,而不是按照常规的IVD产品进行独立评价。例如,Illumina MiSeq Dx囊性纤维化临床测序检测由文库制备和样品提取试剂、测序试剂和消耗品、MiSeq Dx仪器和数据分析软件组成。
二.我国基因测序仪的审评审批情况
在我国,基因测序仪和建库试剂均作为Ⅲ类医疗器械进行管理。虽然与FDA的监管方式存在差异,但我国也极为重视对基因测序仪的管理。由于监管法规体系的不同,我国对基因测序仪和建库试剂、测序试剂采取独立审批的方式。
我国自2014年首次批准基因测序仪,目前我国已有来自十多个公司的基于多种测序原理的基因测序仪产品获得批准。
目前已上市的产品有基于可逆末端终止法的安诺优达基因科技(北京)有限公司的基因测序仪NextSeq 550AR和Illumina公司的基因测序仪MiSeqTM Dx Instrument,NextSeq™ 550Dx Instrument等;基于半导体原理的Life 中山大学达安基因股份有限公司的基因测序仪DA8600和Technologies的PGM Dx等;基于联合探针锚定聚合技术与DNA纳米球原理的武汉华大智造科技有限公司的基因测序仪BGISEQ-50和后续的MGISEQ机型等。其中一部分测序仪采取临床试验的路径验证临床性能,另一部分产品采用同品种比对的路径,与同原理的产品进行对比分析。(见表1)
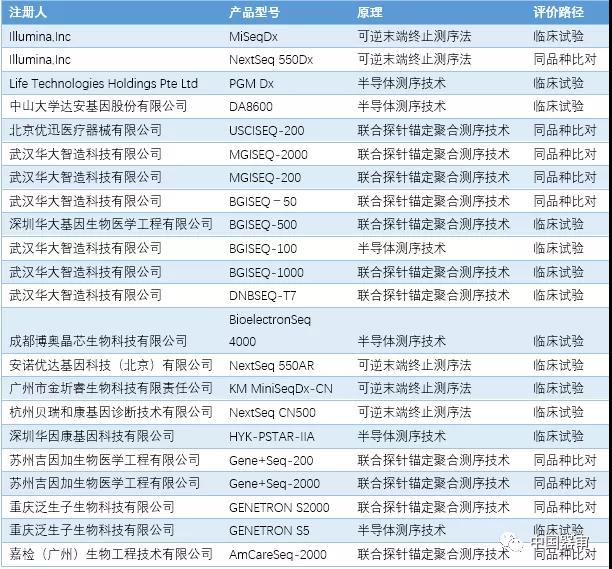
表1:我国基因测序仪批准情况
鉴于基因测序技术平台具有操作和分析较为复杂的特点,针对不同的检测目的和预期用途,采用的样本类型不同,而人类和其他物种基因组信息和结构的差异和多样性会造成检测的核苷酸类型、序列变异类型、测序技术和性能指标方法的差异,例如不同的物种的基因组,不同的变异类型,不同的核酸类型会对基因测序仪产出的数据的质量和通量有不同的要求。因此需要采用有代表性的检测项目来研究产品的临床性能。
小结
基因测序仪作为测序行业的上游关键技术,其临床性能的科学评价对于支持在临床医学的基于测序原理的检验项目的健康发展具有重要意义。中美两国都极为重视对基因测序仪安全有效性的科学评价和管理。美国采取试剂、仪器及软件整体评价的方式,对于测序产品末端的结果的判读具有严格的监管。由于法规体系的不同,我国采用与欧盟相同的监管方式,对基因测序仪和试剂独立审批,但产品同样是作为一个整体进行评价。应当注意,针对NGS产品其自身特点,产品评价中更多关注代表性目标的覆盖性与性能。随着行业的发展和对产品认知的提升,也促使我们需要进一步研究和建立更为科学的临床评价方法,以支持基于测序原理的检验项目的健康发展。
参考文献:
[1] 《高通量测序技术》,李金明主编
[2] Optimizing FDA’s Regulatory Oversight of Next Generation Sequencing Diagnostic Tests s—Preliminary Discussion Paper. U.S. Food and Drug Administration (FDA)
[3] Use of Databases for Establishing the Clinical Relevance of Human Genetic Variants. U.S. Food and Drug Administration (FDA)
[4] Considerations for Design, Development, and Analytical Validation of Next Generation Sequencing-Based In Vitro Diagnostics Intended to Aim in the Diagnosis of Suspected Germline Diseases. U.S. Food and Drug Administration (FDA). 13 April 2018
临床二部 郑生伟 供稿

评论区