原文:https://www.cmde.org.cn/splt/ltwz/ltqt/20181026103900608.html
发布时间:2018-10-26
版权归属原文(原创 2018-10-25 CMDE 中国器审)
一、PMDA 概述
PMDA 全称 为Pharmaceuticals and Medical Devices Agency, 其日语名称翻译为“独立行政法人医药品医疗器械综合机构”, 是厚生劳动省医药食品局所管辖的独立行政法人。PMDA 的业务主要包括审查、安全对策、健康损害救济三大板块,截至2017 年 4 月 1 日的数据显示,审查、安全对策、健康损害救济业务分别有员工 578、190、39 名,其中 2014 年4 月公布的负责医疗器械审查人员数量为 104 名。PMDA 的组织机构图见图1,其中第一个理事及其分支为审查相关的业务部门。
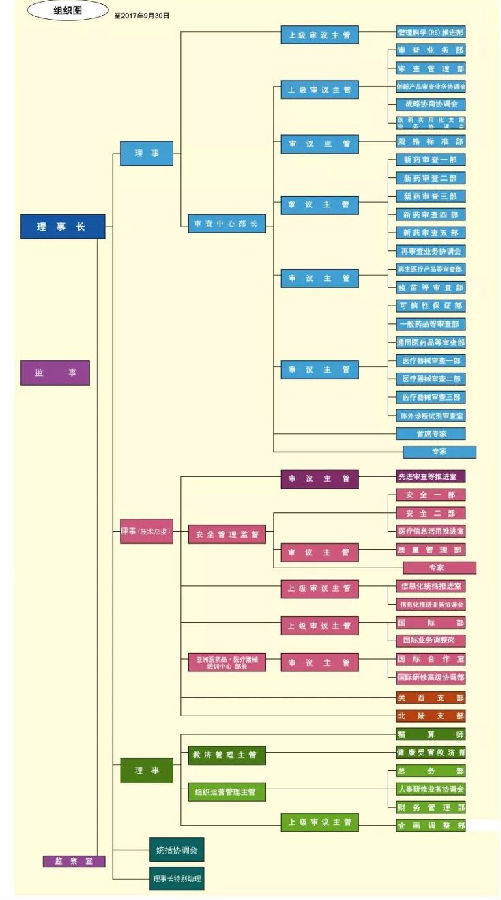
图1 PMDA 组织机构图
二、PMDA 的主要业务
(一)审查
审查业务旨在管控风险、降低风险,是上市前对产品安全有效性的审核,审查业务包括临床试验和其他问题的咨询,对药品、医疗器械和再生医疗产品的合规性审查、再审查 / 再评价 , 针对按法规要求实施的试验的科学性、伦理性进行调查(GCP/GLP/GPSP 符合性评估), 生产过程和设施的 GMP/QMS/GCTP 检查 , 已注册认证机构的检查 , 标准的制修订等。
根据新版《药事法》,对初次获得批准的医疗器械,经一定时期后,要进行再审查。新设计的、结构新颖的或采用新原理的医疗器械,在获得初次批准后第四年,接受再审查。具有新效力、新用途或新性能的医疗器械,则在获得初次批准后第三年,接受再审查。
自 2015 年 10 月医疗器械审查部门实行新体制,由原来两个审查部调整为三个,分工见表 1。
表1 医疗器械审查部门分工
同时设有八个跨部门的小组,包括:
(1)临床评价小组;
(2)生物学安全小组;
(3)电气安全小组(含激光);
(4)软件小组(含网络安全应对);
(5)后发小组(包括合作计划:实质等同的明确化);
(6)国际应对小组,含IMDRF(International Medical Device RegulatorsForum,国际医疗器械监管者论坛);
(7)监管科学小组(监管科学案例策划、与监管科学推进部的协调,以及对非其他小组管辖的监管科学案件的应对);
(8)再生医疗制品审查部、生物源器械办公室(生物源制品的安全性评价)。
(二)安全对策
安全对策业务是指上市后的安全措施,旨在持续性降低风险,是PMDA 与厚生省一同协作,为了保证医疗器械的安全、放心使用而实施。PMDA 与厚生省从制造商、经销商、医疗机构等处收集与医疗器械产品质量、有效性、安全性相关的信息,并对收集的信息进行科学的调查、探讨,形成的安全对应策略。根据各项规定要求,在 PMDA 官网上不仅可以查到审查相关的资料,同时可以查到紧急安全性信息、关于医疗安全信息的通知等。
(三)健康损害救济
健康损害救济旨在为医疗领域健康已受到的伤害采取救助措施,此业务与审评审批业务关系不大,因此本文未深入研究探讨。
三、PMDA 的承认审查
1. 新医疗器械:与已批准的医疗器械在结构组成、使用方法、效果及性能方面有明显差异的医疗器械。
2. 改良医疗器械:不属于新医疗器械或后发医疗器械的医疗器械。
3. 后发医疗器械:被认为与已批准的医疗器械在结构组成、使用方法、功能、效果及性能等有等同性的医疗器械,即与已批准医疗器械在构造、使用方法、效果及性能本质上等同的产品,申请认证或承认时不需要提供临床试验数据。
新医疗器械与改良医疗器械一般无相应的审查标准,无论风险等级为Ⅱ、Ⅲ还是Ⅳ级,均由 PMDA 进行审评,厚生省承认。自 2009 年起,对于已有审查标准的后发医疗器械,可由第三方认证机构认证;无审查标准的后发医疗器械仍由 PMDA 审评,厚生省承认。根据 PMDA 公开的 2016 年度工作 报 告 中 的 数 据,2014~2016 年 度PMDA 审评的各类医疗器械数量见表 2。
表2 PMDA2014~2016 年度承认的医疗器械数量
注:1.日本的财政年度采取跨历年制,从当年4月1日至下年的3月31日止,例如2016年度指2016年4月1日至2017年3月31日;
2.括号中数字为优先品种数量;
3.括号中数字为开展临床试验的品种数量。
日本医疗器械获得承认的流程见图2:
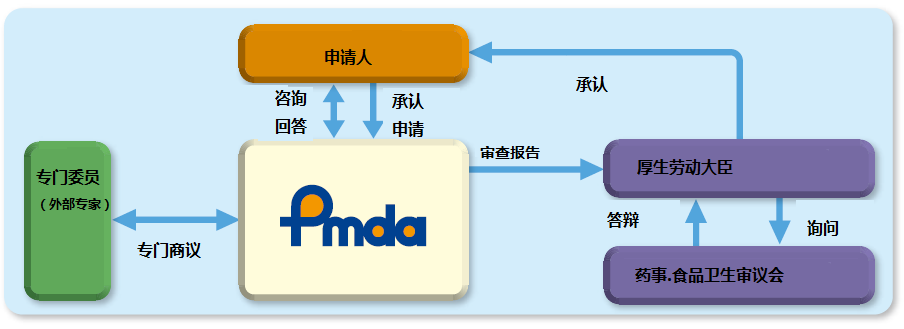
图2 医疗器械承认流程图
专门委员由 PMDA 从各学科中经验丰富者中选出并任命 , 名单在PMDA 网站公布。与专门委员商议的制度与我中心的专家咨询制度类似,有信函商议和会议商议两种方式,2016 年度共计开展了 71 次信函商议,17 次会议商议。
(审评二部 陈敏 刘静静 供稿)

评论区