原文:https://www.cmde.org.cn/splt/ltwz/ltqt/20180326094600254.html
发布时间:2018-01-09
版权归属原文(原创 2018-01-09 CMDE 中国器审)
美国FDA器械和放射健康中心(以下简称CDRH)负责美国医疗器械的全生命周期的监管。目前,在其内部正在酝酿一次较大规模的机构改革,主要将从组织架构、工作流程和工作理念等方面入手。
一、组织架构
CDRH此次改革的最主要改变发生在组织架构层面。CDRH努力建立一个更加灵活的组织架构以适应技术的发展以及由此带来的医疗器械全生命周期特点的变化,使架构能够满足今后组织、监管和技术发展的要求。此外,新架构设定的另一个主要目标是通过精简组织层级,简化工作流程,使得信息共享更加便利,部门间沟通更加顺畅,提高工作效率。在组织架构变化的同时,设置更多创新型多职能岗位,这些岗位除满足新架构的职能需求外,还可以促进员工能力的全方位发展。
CDRH现有架构包括8个办公室,分别为:中心主任办公室、交流和教育办公室、合规性办公室、器械审评办公室、体外诊断和放射健康办公室、管理办公室、科学与工程实验室办公室以及检测与生物学统计办公室。此次改革,拟将合规性办公室、器械审评办公室以及检测与生物学统计办公室合并(见图1)。
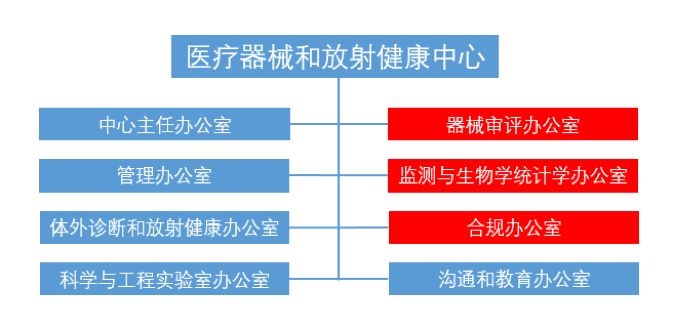
图1 CDRH现有组织架构
合并后的部门被称为“超级办公室”(Super Office)。这个超级办公室下设项目管理办公室、临床及分析办公室以及6个不同类别的器械审评办公室(见图2)。其中,项目管理办公室包括资料提交部(主要负责递交资料的收集与分类)、工作组建部(主要负责注册、质量体系监管核查等审批相关工作项目的组建)、市场信息部(主要负责产品的缺陷和召回、质量控制、项目证明周期管理等)。临床及分析办公室包括临床证据政策部与生物学统计部。
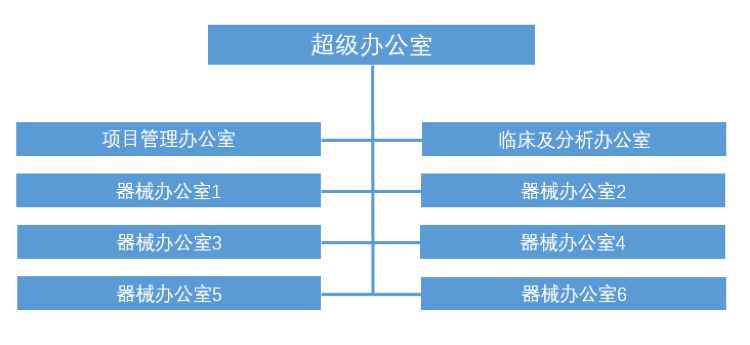
通过将之前处于同一层级的不同办公室之间的沟通转化为同一办公室内各部门之间的协调,使工作效率有了大幅提高。
二、工作流程
工作流程的改进过程中,为确保各部门、各办公室间流程和政策的一致性,使员工明确自身岗位职责,CDRH将对内部流程、协调性及沟通顺畅性作进一步优化,以达到在CDRH内部直接、简明的沟通方式。在上述组织架构进行调整的同时,工作流程也进行相应的优化,在条件允许的情况下尽可能采用“一站式”解决方案。为应对日新月异的新技术带来的创新器械与常规器械在全生命周期特点方面的差异,CDRH采用更为灵活的架构改进工作流程,以适应不断变化的新技术和监管需求,通过各种手段实现信息共享、信息公开,加强部门内和部门间的团队协作,以利于部门内、部门间决策的进行。
三、工作理念
此次,CDRH在工作理念中体现了以员工发展为核心的原则。首先,在组织架构的改革中增加创新型职位,为员工提供跨领域发展机会,使员工有多专业方向发展的可能。其次,促进员工的相互交流,充分发挥员工所掌握的器械上市前和上市后的信息,在丰富员工对于医疗器械全生命周期特点了解的同时,有助于优化领导者的决策,减少领导者“做出决定”,以提高员工权力。最后,CDRH在整个改革计划中也多次强调,要通过提高工作效率和组织包容性,使员工工作量处于合理水平,让管理者和普通员工都能够兼顾工作和生活,以达到减少离职率提高服务年限的目的。
上述改革方案制定后,CDRH还会与申请人进行充分沟通,听取各方的意见,进一步完善方案。作为一系列改革的最终目的,CDRH希望充分发挥现有员工的工作能力、不断适应新的监管要求,对医疗器械全生命周期实现更加有效的监管。改革方案将在2017年年底向FDA递交,预计获得批准将需要至少6个月的时间。
(高宇 傅继欢 焦童 韩从音 吴琨)

评论区