原文:https://www.cmde.org.cn/splt/ltwz/ltqt/20081211024900261.html
发布时间:2008-12-11
版权归属原文美国医疗器械监管至今已有一百多年的历史,而其监管部门美国食品药品管理局(以下简称“FDA”)也已从1862年美国农业部的一个化学办公室发展成为世界上重要的食品、药品、医疗器械监管机构。由于美国最早立法管理医疗器械,其创立的分类管理办法已被普遍接受,因此美国管理医疗器械的法规和模式在国际上有很大的影响力。下面将从几方面对其管理概况进行介绍,以期能够借鉴其先进的监管理念和经验,总结并找出更加适合我国国情的医疗器械监管方式。
一、立法状况
1976年美国国会正式通过了《食品、药品和化妆品法》(Federal Food,Drug,and Cosmetic Act,简称“FD&C Act”)修正案,加强了对医疗器械进行监督和管理的力度,并确立了对医疗器械实行分类管理的办法。这是国际上第一个国家立法,并规定由政府行政部门对医疗器械进行监督管理。而在后续的30多年间,美国国会又先后通过了医疗器械安全法案 (SMDA)、乳腺X线设备质量标准法案(MQSA)、FDA监管现代化法案(FDAMA)、医疗器械申报费用和现代化法案 (MDUFMA) 、医疗器械申报费用稳定法案 (MDUFSA) 、FDA 修正法案 (FDAAA)等一系列规定,在1976年修正案的基础上又增加了许多内容,始终确保法规与医疗器械发展相适应。
美国联邦食品药品和化妆品法令是美国联邦法典第九章,通常称其为标题21(Title 21)。此部分是对食品、药物、医疗器械的规定,共9卷,由1-99部分、100-169部分、170-199部分、200-299部分、300-499部分、500-599部分、600-799部分、800-1299部分以及1300部分至结束组成,其中前8卷(1-1299部分)包括第I章—食品及药物管理局、卫生和福利部。第9卷(1300部分至结束)包括第II章—禁药取缔机构、律政司署以及第III章—国家药物控制政策办公室。
而在这些卷当中,第8卷的800-1299部分为医疗器械的法令,依产品要求不同分为5个子章节,分别为子章节H—医疗器械、子章节I—乳腺造影质量标准法案、子章节J—放射卫生、子章节K【预留】、子章节L—食品及药物管理局依照某些其他的法案执行的法规。在这些子章节中,对医疗器械监管的不同环节,如对标识、厂商、召回的权限、质量体系规章、医疗设备分级程序、性能标准形成的程序等内容分别进行了规定,均用“第XXXX.XXXX节”这种法规代码的形式表示。对于通用概念性内容,在法规代码后一般会给出详细的描述,包括定义、使用目的、一般要求和原始出处;而对于具体的医疗器械项目,则列出其通用项目名称、定义、分类、要求及原始出处。
二、组织机构设置及运作方式
(一)组织机构设置
FDA是美国人类和健康服务部(Department of Health & Human Services,简称“DHHS”)的下设机构之一。其组织架构类似于我国的海关系统,为垂直管理,由FDA总部和美国各大区、地区派驻机构组成,人员统一由FDA管理。截至目前,FDA共有超过10000名雇员,其中近三分之二的雇员在FDA总部工作,而其他近三分之一的雇员则在包括5个大区办公室和20个地区办公室在内的近150个办公室和实验室工作。
FDA总部共由生物制品评价研究中心(CBER)、器械和放射产品健康中心(CDRH)、药物评价研究中心(CDER)等部门组成。除血源筛查的医疗器械由生物制品评价研究中心(CBER)负责管理外,其余的医疗器械产品均由器械和放射产品健康中心(CDRH)负责管理。
其中,器械和放射产品健康中心主要负责下列工作:
1.对科研或者临床用途的医疗器械申请进行审查。
2.收集、分析并处理医疗器械和放射性电子产品在使用中有关损伤和其他经验的信息。
3.为放射性电子产品和医疗器械建立良好生产实践规范(Good Manufacturing Practice,简称GMP)以及性能标准,并组织实施。
4.对医疗器械和放射性电子产品的符合性进行监管。
5.为小规模医疗器械生产企业提供技术性及其他非经济性帮助。
CDRH下设六个办公室,有器械评价办公室、科学及工程技术办公室、体外诊断试剂评价安全办公室、交流教育办公室、符合性办公室以及生物统计和监督办公室,约有雇员1100人,负责不同种类、不同方面医疗器械的管理
(二)运作方式
在美国,医疗器械的上市前审批由FDA总部进行统一管理,虽然有一部分产品可由第三方机构进行审评,但最终的批准权都还是在FDA总部,大区办公室和地区办公室等地方派驻机构都没有上市前审批的权限。而地方派驻机构主要是在日常监管中发挥作用,他们在法律授予的职责范围内完成自己的工作,并协助FDA总部完成一些其他工作。
三、产品分类
FDA对医疗器械实行分类管理,根据风险等级和管理程度把医疗器械分成3类进行上市前管理。FDA从科学、工程和临床专家以及消费者和工业组织推荐的候选人中挑选出一些专家组成分类专家委员会,其中消费者和工业组织代表没有投票权。FDA会根据专家委员会的建议最终决定医疗器械产品的详细分类,在定期公布这些分类结果的同时,每年还会对法规代码库进行更新。
I类产品为“普通管理(General Controls)”产品,是指风险小或无风险的产品,如医用手套、压舌板、手动手术器械等,这类产品约占全部医疗器械的30%。FDA对这些产品大多豁免上市前通告程序,一般生产企业向FDA提交证明其符合GMP并进行登记后,产品即可上市销售。
II类产品为“普通+特殊管理(General & Special Controls)”产品,其管理是在“普通管理”的基础上,还要通过实施标准管理或特殊管理,以保证质量和安全有效性的产品,这类产品约占全部医疗器械的62%。FDA只对少量的II类产品豁免上市前通告程序,其余大多数产品均要求进行上市前通告(510K)。生产企业须在产品上市前90天向FDA提出申请,通过510K审查后,产品才能够上市销售。
III类产品为“上市前批准管理(Pre-market Approval,PMA)”产品,是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等,这类产品约占全部医疗器械的8%。FDA对此类产品采用上市前批准制度,生产企业在产品上市前必须向FDA提交PMA申请书及相关资料,证明产品质量符合要求,在临床使用中安全有效。FDA在收到PMA申请后45天内通知生产企业是否对此申请立案审查,并在180天(不包括生产企业重新补充资料的时间)内对接受的申请做出是否批准的决定,只有当FDA做出批准申请的决定后,该产品才能上市销售。
总体来讲,FDA总部对近60%的医疗器械进行上市前通告(510K)或者上市前批准(PMA)的审查。
四、注册形式及审批过程
在前面我们已经提到FDA按风险等级对医疗器械实行分类管理,并由FDA总部对近60%的医疗器械进行上市前通告(510K)或者上市前批准(PMA)的审查,下面,将逐项地对不同种类产品的注册形式和审批过程进行详细描述。
(一) 豁免上市前通告的产品
绝大多数的I类产品和少量II类产品属于豁免上市前通告的产品,这类产品上市无需经过FDA审批,只需生产企业确认其产品符合相关规定,如:产品说明书、标签和包装标识符合21CFR801、809、812的要求,产品设计和生产符合21CFR820的要求等,并由生产企业向FDA提交保证其产品符合GMP的备案表后,这类产品就能够上市销售。
(二)需要进行上市前通告(510K)的产品
1.上市前通告(510K)的流程
510K是指通过对拟上市产品与已上市产品在安全性和有效性方面进行比较,在得出实质性等同(Substantial Equivalence,简称SE)结论的前提下,进而获得拟上市产品可以合法销售的上市前通告的一条法规路径。绝大多数II类产品属于需要进行上市前通告(510K)的产品,这类产品是在普通管理的基础上增加一些特殊要求,如:对标识的特殊要求、符合某些性能标准、符合FDA的指南等,以确保其临床使用中的安全性和有效性。这类产品通常要由申请人提交资料证明其与已上市产品实质性等同(SE),经过FDA审查并取得510K确认信后方可上市销售。同时,因其所涉及的具体情况不同,上市前通告又分为传统510K(Traditional 510K)、简略510K(Abbreviated 510K)和特殊510K(Special 510K)三个类型。下面将在表1中给出这三种不同类型申请的具体内容。
表1 三种类型510K申请对照
申请人应根据拟申请上市产品的情况在产品上市90天前向FDA提出不同的510K申请并报送相关资料,FDA在收到申请人提交的510K申请和相关资料后,首先会返回给申请人一封收到申请的确认信,并给予该申请一个K号,随后申请产品将在相应的部门进行审查,审查部门被要求在30天内对申请资料进行审查,并作出是需要申请人补充资料还是出具判断信。如需要补充资料,则以官方书面方式通知申请人需补充何种资料。待申请人按要求补充完申报资料后,审查部门会重新开始进行一个为期90天或30天的审查过程,根据补充资料及原申报资料的综合情况对该510K申请做出最终判断。如判断为与已上市产品实质性等同,则发给申请人一封实质性等同的确认信,也就是我们经常看到的510K信,该产品就可以上市销售了。如判断为与已上市产品不是实质性等同,则发给申请人一封非实质性等同的确认信,告知申请人可以用新的信息重新提交另一份510K申请或者提出PMA申请。至此,一份510K的审查就进行完毕了。
2.实质性等同(SE)的判定标准
顾名思义,实质性等同是指拟上市产品与已上市产品相比,在安全性和有效性方面达到了相同水平。在美国,已上市产品是指满足下列条件之一的产品:
(1)1976年5月28日前合法上市的。
(2)从III类被重新划分到II类和I类的。
(3)经过510K审查被认定为实质性等同的。
与已上市产品进行对比后,达到下列标准之一的则被认为达到实质性等同:
(1)具有相同的预期用途及技术参数。
(2)具有相同的预期用途及不同的技术参数,但没有引起安全性、有效性方面新的问题,且能够证明与已上市产品具有相同的安全性和有效性,相关信息已提交给FDA。
(三)需要进行上市前批准(PMA)的产品
1.PMA的申请
所有的III类产品和新产品均属于需要经过上市前批准(PMA)方可合法上市,申请人必须按照21CFR814.20的要求向FDA提出PMA申请并报送相关资料。
PMA申请根据情况不同可分为新的PMA申请和PMA补充申请,其中新的PMA申请是指申请人对所生产的从未被FDA批准过的III类产品或新产品提出的申请,而PMA补充申请则是申请人拟对一个已批准PMA申请的产品进行影响安全性和有效性的改变前提出的申请。
对于上述PMA申请,FDA将在收到申请后的45天内,书面通知申请人该申请是否已经被立案审查。如果FDA拒绝立案,将书面通知申请人申请中存在的缺陷及拒绝立案的理由,申请人可以选择按照通知要求补充资料后重新申请,也可以要求重新讨论或者复审;如果FDA决定立案审查,书面通知中将包含该PMA的引用编号和立案日期,并开始为期180天的审查。
2.PMA的审查过程
FDA对该PMA申请进行行政性、科学性和法规性审查的同时,该申请还将被顾问委员会审查,顾问委员会审查后会向FDA提交一份包括有对该PMA的建议及做出这些建议的根据的报告,FDA会综合上述审查结果做出结论,一般有以下两种情况:
(1)如未发现该PMA申请具有21CFR814.45中规定的任意一种拒绝批准的情形,则FDA将为申请人发布一项批准该PMA申请的指令,并给申请人寄去可批准信件,可批准信件中包括FDA要求申请人提供的信息或为获得批准要求申请人符合的条件。申请人在收到可批准信件后可向FDA做出按照信件要求修正该PMA,或者申请再审查,或撤销该PMA申请的答复。
(2)如认为该PMA申请具有21CFR814.45中规定的一种或几种拒绝批准的情形,则FDA将给申请人寄去不可批准信件,不可批准信件中包括申请中存在的缺陷、适用依据及确定该PMA可被批准要求申请人采取的措施。申请人在收到不可批准信件后可向FDA做出按照信件要求修正该PMA,或者申请再审查,或者撤销该PMA申请的答复。
3.PMA修正
在PMA申请已被立案之后,申请人可以对尚未做出最后决定的PMA申请或PMA补充申请主动进行修改,但应说明提交修改的原因。FDA也可要求申请人修正PMA申请或PMA补充申请中的任何信息以便于FDA或适当的顾问委员会完成对上述申请的审查。
4.PMA判定
根据申请人答复的不同,FDA也会做出下列不同的判定:
(1)申请人根据信件要求提交了PMA修正,且经过审查符合相关要求,FDA会发给申请人PMA批准信,一般在该批准信内FDA会按照21CFR814.82的规定增加对该PMA批准后的要求。
(2)申请人未在180天内以书面形式对FDA发出的书面修正、可批准或不可批准信件进行答复,或以书面形式通知FDA已撤销该PMA申请,FDA将会作出撤销该PMA的决定。
(3)如果申请人按照可批准或不可批准信件的要求递交了修正,但在法规中依然有拒绝批准的根据;或申请人以书面形式通知FDA将不递交要求的修正的,FDA将会做出拒绝批准该PMA的决定。
5.PMA再递交
PMA申请或PMA补充申请被撤销或者PMA申请或PMA补充申请被拒绝批准后,申请人可以对上述申请再次递交,但应与21CFR814.20或814.39的要求一致,并且包括第一次递交时分派的PMA编号和申请人再次递交该申请的原因。
(四)可由第三方(Third Party)审核的产品
对于占有60%美国市场份额的II类产品,FDA在麻醉、心血管、临床化学、牙科、耳鼻喉、肠胃、整形外科、常规设备、血液学、免疫学、微生物学、神经学、产科、眼科、病理学、物理治疗学、放射学和毒物学等15类产品范畴中,抽取了部分产品(I类和II类需要完成510(K)申报方能进入美国市场、不属于植入式、支持或维护生命设备、且不需要进行人体临床研究的产品)授权给了11家机构(表2所示)进行第三方审核,从而加快了这类产品完成美国市场准入的进度。(当然,对于可由第三方审核的医疗器械,制造商仍然可以向FDA直接申请市场准入审核,而并非必须要经由第三方机构。)
表2 FDA授权第三方审核机构列表
1.成为FDA授权第三方审核机构应具备的资格
美国食品药品及化妆品法案FD&C Act第704条款规定了成为FDA授权第三方审核机构应满足的基本要求:
(1)必须是合法的实体机构,但不得隶属于联邦政府。必须是不受制造商、供应商或卖主控制的独立组织,不和制造商、供应商和卖主之间有组织结构上、实际性的和财务上的利益关系,并且不从事医疗器械的设计、装配、销售或维修工作。
(2)必须有足够的拥有审核和检查经验、技巧及受过必须培训和教育的工作人员,FDA要求第三方审核机构工作人员应当熟悉美国食品药品及化妆品法案(FD&C Act)、公众健康服务法(Public Health Service Act)以及21CFR相关法规的要求。
(3)FDA将采用TPRB(Third Party Recognition Board)程序来评估申报机构是否具备第三方审核能力。
2.FDA授权第三方审核机构市场准入审核流程: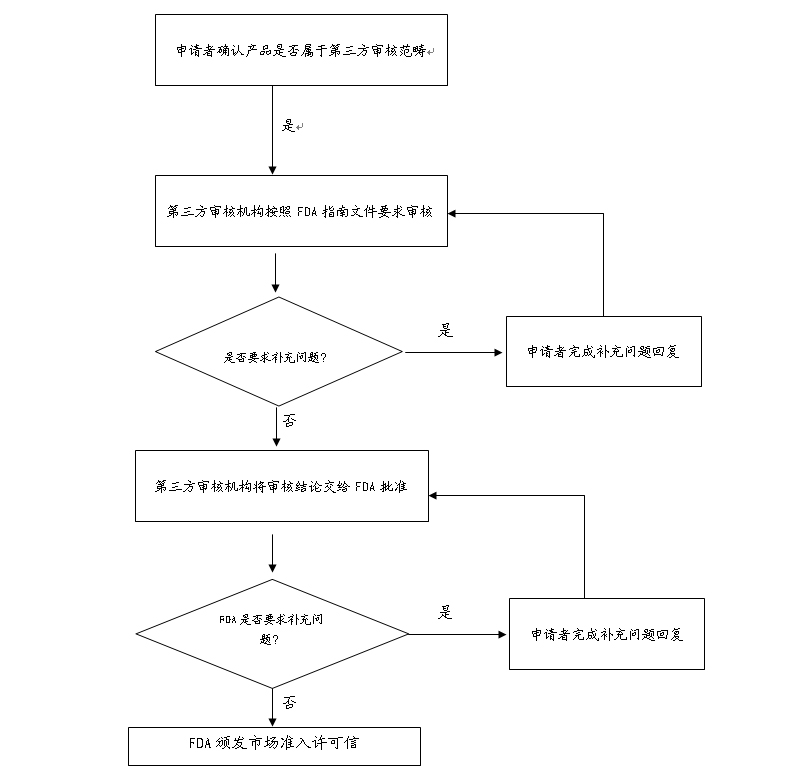
第三方机构在对制造商递交的市场准入文档进行初步审核后,将审核意见、建议以及510(K)文档转交给FDA,按照法规的要求,FDA必须在30天之内作出是否颁发市场准入许可信的决定。选择FDA授权第三方审核机构与选择直接向FDA递交市场准入审核差异表如下所示:
3.FDA对第三方审核机构的监管
隶属于FDA器械和放射卫生中心(CDRH)的投诉监督办公室(OC)将对FDA授权的第三方审核机构依法进行监管。
FDA将会对由第三方审核机构完成的审核项目进行复审,并定期对第三方审核机构进行检查,以确保它们按照法规的要求进行相关审核工作并记录过程。当有足够的证据表明,第三方审核机构与申报者之间存在着利益关系,FDA将会按照FD&C Act 704条款的要求启动撤销第三方审核机构资格的程序。
FD&C Act 704条款规定,当第三方审核机构未按照标准和法规的要求履行程序,对公众健康带来威胁,或与设备制造商等机构之间存在利益关系时,FDA将会撤销第三方审核机构资格。而截止到目前为止,FDA尚未对已经授权的第三方审核机构做出撤销资格的判定。
五、临床研究的管理
在美国,有10%-15%的II类产品在申请上市前通告(510K)及全部III类产品在申请上市前批准(PMA)时,都必须提交临床研究资料。
对于需要提交临床研究资料的产品,根据其风险程度的不同,又分为具有重大风险的器械(Significant Risk Device)和不具有重大风险的器械(Non-Significant Risk Device)。其中,具有重大风险的器械在进行临床研究前,试验发起人必须向FDA和机构审查委员会(Institutional Review Board,简称IRB)提出申请,在经这两个机构审查并获得批准后,临床研究方可开展。而不具有重大风险的器械在进行临床研究前,试验发起人只需向IRB提出申请,经审查获得批准后临床研究即可开展。下面将对这两种不同的临床研究管理方式进行简要的说明。
(一) 具有重大风险的器械(Significant Risk Device)
在21CFR812.3中,对具有重大风险的器械定义为:植入人体,用于支持或维持生命,对于诊断、治疗、减轻或处理疾病有重要作用或者防止人体健康受到损害的器械。
如果试验发起人判断拟进行临床研究的器械为具有重大风险的器械,那么试验发起人应当按照21CFR812.20的要求向FDA提交一份完整的IDE (Investigational Device Exemptions)申请的同时,按照21CFR812.25和21CFR812.27的要求向IRB提交临床研究计划和预先研究报告。
FDA在收到发起人递交的IDE申请后,将会通知发起人受到申请的日期,并给予该IDE申请一个编号。而IRB在收到发起人递交的临床研究计划和预先研究报告后,会对这些资料进行审查,并有权作出批准、要求改进和拒绝批准的决定,而这些决定都将被发送给FDA。通常FDA会根据IRB的建议并依据21CFR812.30的规定在30日内作出批准、有条件批准、拒绝批准或撤销批准的决定,书面通知发起人。如发起人收到拒绝批准或撤销批准的通知,如发起人对上述通知持有异议,可以依据21CFR第16部分的规定提请听证。
在IDE申请被FDA批准之后,发起人必须保证进行临床研究的器械符合21CFR812.5(标签)、21CFR812.43(挑选研究和监管人员)、21CFR50(受试者知情同意书)、21CFR812.46(监管研究)、21CFR812.7(禁止宣传和其他行为的禁令)、21CFR812.140(记录)和21CFR812.150(报告)的要求后,方可开展临床研究。在临床研究的过程中,IRB应当按照21CFR56部分的规定对临床研究进行持续审查,FDA在临床研究的过程中,可以对诸如设备存在的任何场所、记录以及病人记录等内容进行任何方式的检查,始终确保临床研究符合法规要求。
(二) 具有非重大风险的器械(Non-Significant Risk Device)
具有非重大风险的器械即是除具有重大风险器械以外的器械,此类器械进行临床研究不必向FDA提交IDE申请,只需按照21CFR812.2(b)的要求直接向IRB提交简略IDE申请,并提交拟进行临床研究的地点和判断拟进行临床研究的器械不具有重大风险的依据。如果IRB不同意并且判断该器械具有重大风险,发起人必须在5个工作日内将此信息报告给FDA,FDA如果判断该器械为具有非重大风险的器械,并且在此问题上与IRB进行沟通并取得一致意见,将会批准这个IDE申请。
而一旦IDE申请被FDA或IRB批准之后,发起人也必须保证进行临床研究的器械符合21CFR812.5(标签)、IRB的批准、21CFR50(知情同意书,除非IRB根据21CFR56.109C的要求予以豁免)21CFR812.46(监管研究)、21CFR812.140(记录)、21CFR812.150(报告)、研究者的记录和报告以及21CFR812.7(禁止宣传和其他行为的禁令)的要求后,方可开展临床研究。在临床研究的过程中,IRB应当按照21CFR56部分的规定对临床研究进行持续审查,FDA在临床研究的过程中,可以对诸如设备存在的任何场所、记录以及病人记录等内容进行任何方式的检查,始终确保临床研究符合法规要求。
任何一个被批准的临床研究在开始后进行的过程中,如果需要对临床研究计划有所改变,应当按照21CFR812.35的规定向FDA或者IRB提交相应的资料,如需FDA的批准,临床研究应当在FDA批准后方可继续进行。
六、上市后监管
FDA要求生产企业保证产品是在符合GMP要求的条件下生产出来的。在产品上市后,FDA会通过质量体系检查,建立追溯制度,不良事件报告,召回等手段来进行监管。
(一)质量体系检查
对于I类产品,FDA一般每四年检查一次质量体系,对于II、III类产品,FDA一般每两年检查一次质量体系。但若发现问题,FDA可随时对生产企业进行检查。并且,FDA可通过发警告信、扣押产品、强制召回产品等手段进行行政处罚,还可以通过新闻媒介影响生产企业。
(二)追溯制度
美国联邦法规21CFR821部分规定了对于在设备单位外使用的用于支持、维持生命的设备或永久植入性设备,例如:心血管永久起搏电极,人工心脏瓣膜,直流除颤器等,产品制造商和销售商应当建立追溯制度,确保产品从生产开始,到销售网络(包括批发商、零售商、租赁商、其他商业企业、设备使用单位和得到许可的从业者),到使用设备的患者这一系列环节都是可追溯的,保证已上市产品的有效性。
(三) 不良事件报告
美国联邦法规21CFR803部分规定了不良事件报告制度,要求医疗器械的制造商、进口商和使用单位,必须对已经造成的死亡和严重伤害事件,或正在引起并可能造成的死亡和严重伤害事件的医疗器械,必须建立和维护不良事件档案,并向FDA提交详细的报告。同时,还要求医疗器械分销商也要保留不良事件记录。
(四) 召回
生产企业如对已上市的医疗器械发现质量问题,可以自行将产品召回,避免造成进一步的伤害。而美国联邦法案21CFR810部分则规定了美国食品药品监管部门在监管过程中行使召回权力的程序,在其监管过程中,一旦发现医疗器械很可能导致严重不利于健康的后果或致人死亡,FDA可以下达一个停止销售的命令。在命令下达之后,生产企业可以按照21CFR810.11的规定申请规章听证,规章听证可能会做出维持停止销售、修改停止销售和通告命令或强制要求生产企业召回医疗器械的决定。一旦FDA向生产企业发出了强制召回的命令,那么,所有已经流入市场的医疗器械均应当被召回,以保证不对人体健康造成更大的伤害。
七、其他
(一)出口证明(CFG)
为了使美国生产企业生产的医疗器械能够出口到世界其他国家或地区,FDA会给拟出口的器械开具致外国政府证书(CERTIFICATE TO FOREIGN GOVERNMENT,简称CFG),在这个证书上会记载有下列信息:
(1)证书编号;
(2)产品名称(如拟出口的产品较多,会以附页形式列出);
(3)生产企业或者分销商的名称和地址;
(4)所载产品在美国市场上已有销售;
(5)生产所载产品的工厂符合GMP的要求;
(6)签署人签名、职位、单位;
(7)公证人签名、所属公证机构、公证权截止日期;
(8)证书生效期、有效期。
(二)由生物制品评价研究中心(CBER)负责管理的产品
根据1991年CDRH和CBER之间的谅解备忘录,有部分医疗器械由CBER负责管理,具体项目如下:
(1)与生物试剂共同使用的质量评价(QA)试剂。
(2)用于许可的生物制品的血浆去除机。
(3)用于血库的仪器、软件及数据管理系统。
(4)用于供体筛查检测的试剂,如:乙型肝炎病毒表面抗原(HBsAg)、乙型肝炎病毒核心抗体(HBc)、丙型肝炎病毒(HCV)等。
(5)血红细胞试剂。
(6)用于HIV-1/2和HTLV-I/II检测的试剂。
(7)填充RhoD的注射器/采血管(syringes)。
(三)收费情况
FDA依据美国联邦法律的规定,对涉及医疗器械的不同种类的申请项目规定了不同的收费标准,表3给出了FDA在2008-2012年这段时间内,对不同种类医疗器械申请项目执行的收费标准:
表3 常见医疗器械注册申请费用一览表
注:①收入总额或销售额小于3000万美元的公司申请第一个PMA时,FDA将给予其豁免PMA收费的优惠政策。
②当产品设计或者性能发生重大变化,或者器械具有新的预期用途并且通常需要临床数据来支持。
③产品组成、原材料、设计、规格、软件、颜色添加剂和标签发生重大变化。
④诸如生产工艺、灭菌、标签、软件或者设计的次要变化。
(审评三处供稿)

评论区