原文:https://www.cmde.org.cn/splt/ltwz/ltqt/20171103084700778.html
发布时间:2017-11-03
版权归属原文(原创 2017-09-15 CMDE 中国器审)
一、引言
目前由于各种形式的创伤及疾病导致的组织、器官的缺损或功能性丧失已经成为危害人类健康的主要原因之一。组织、器官的修复和功能重建成为生物医学领域面临的重大挑战。传统组织移植治疗方式受到器官来源、伦理及免疫排斥等方面的限制无法满足临床需求【1】【2】,组织工程技术的发展为临床带来了新的思路和希望。
组织工程技术就是将生命科学和工程学的原理与技术相结合,在体外、离体或体内条件下,应用科学原理和方法构建具有生物活性功能的替代物或移植物,使组织和器官的结构和功能得到修复或再生,用于医学诊断和治疗的技术。已有临床研究证明组织工程技术具有广阔的应用前景【3】组织工程医疗产品是指用组织工程技术和工艺制备的,用于修复、改善、再生组织或器官结构与功能的医用产品(不包括传统的组织和器官移植以及单纯的体细胞及基因治疗产品)【4】。
各国监管机构对此类产品十分重视,美国、欧盟等地区均已发布相关法规文件来指引该产业的发展并对其加以管理,我国监管机构对此类产品的发展也高度关注,目前正在积极组织各方力量研究更加适合我国国情的组织工程医疗产品监管方式。
本文将对于目前组织工程医疗产品的审评审批现状做简要的介绍。
二、我国组织工程产品审评审批情况
1.含活细胞组织工程产品
该类产品的主要原理是从人体取少量细胞,经过体外扩增后种植到支架材料上,经过体外培养形成工程化组织后再植入体内,修复相关组织缺损并恢复原有功能。
根据现行法规规定,含活细胞的组织工程产品属于组合产品,其活细胞及生物活性物质属于生物制品部分,其组织工程支架属于医疗器械部分。
2007 年11 月,国家食品药品监督管理局批准中国第一个含活细胞组织工程产品上市,该产品由医疗器械技术审评中心和药品审评中心联合进行审评,按照医疗器械进行了批准,商品名为“安体肤” ,该产品是一种双层人工皮肤替代物:表皮层由人表皮细胞构成,真皮层由人成纤维细胞和牛胶原蛋白构成,适用于深Ⅱ度烧伤创面和不超过20平方厘米的Ⅲ度烧伤创面(直径小于5厘米)。继美国后中国成为第二个拥有组织工程皮肤产品的国家。另有组织工程人角膜内皮产品,目前尚未申报注册,但已界定为创新医疗器械产品,2017年总局相关部门牵头成立专门的审评审批联合指导工作组并制定了工作方案。
2.脱细胞组织工程产品
该类产品的主要原理是从人体取部分组织,经过脱细胞处理后,降低其免疫原性,再经过灭菌等其他一系列处理过程后形成医疗器械,植入人体后可引导人体组织的修复和重建以及恢复部分功能。
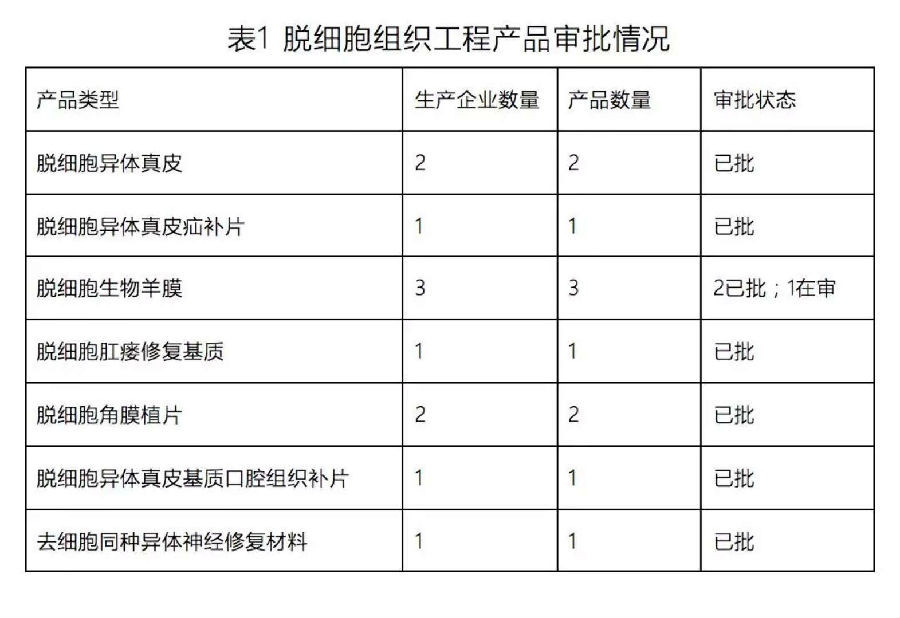
我国目前审评审批的脱细胞组织工程产品情况如表1所示:
三、我国组织工程产品注册相关指导性文件
目前我国针对组织工程产品发布的指导性文件有国食药监械[2007]762号文件“关于发布组织工程医疗产品研究及申报相关要求的通告”。该文件从医疗器械的角度对于含活细胞组织工程医疗产品的研究要求和申报资料要求做了原则性的规定。目前总局药品审评中心也起草了《细胞制品研究与评价技术指导原则》并在其网站上对外征求意见。
四、美国FDA组织工程医疗产品管理方式及现状
美国食品药品管理局(Food and Drug Administration, FDA)作为最早开始关注组织工程医疗器械产品安全性评价和监督管理的重要性的机构,在1993年就组建了FDA组织工程工作组(Tissue Engineering Working Group, TEWG),由医疗器械和放射卫生中心(Center for Devices and Radiological Health, CDHR)、生物制品评价研究中心(Center for Biological Evaluation and Research, CBER)、药品评价研究中心(Center for Drug Evaluation and Research, CDER)和食品安全与应用营养中心(Center for Food Safety and Applied Nutrition, CFSAN)共同参与组成。
由于组织工程类产品存在多学科交叉的现象且产品类型复杂多样,对于药品/器械/生物制品的组合产品或管理属性有争议的产品,由FDA的组合产品办公室(The Office of Combination Products, OCP)根据产品“主要作用机理”指定产品上市前负主要责任的审评机构(CDER/CDRH/CBER)。具体执行方法为:企业向OCP提交“设计文件”(Request for Designation, R&D)用以说明产品的“主要作用机理”; OCP在60天的工作时限内完成界定工作;当企业对OCP界定结果仍存争议时,由属性界定委员会(两管理机构派一名代表组成)进行仲裁。
目前对于组织工程医疗产品,CDRH主要负责审评:
(1)明确界定为医疗器械的产品,例如动物胶原骨填充物、动物组织衍生的韧带替代支架;
(2)以器械为主的组合产品,例如用自体细胞涂覆的牙种植体、用于促进其整合的牙科植入物和合成肽、伤口敷料用药物软膏,含有生物成分的封闭性伤口敷料;
CBER主要负责审评:
(1)明确界定为生物制品的产品,例如用于软骨修复的自体培养软骨细胞;
(2)以生物制品为主的组合产品,例如用于器官替代的自体细胞和支架;
(3)尚未明确界定为生物制品或医疗器械的产品,例如在合成材料或复合胶原材料上培养细胞(成纤维细胞和角质形成细胞/神经/韧带/骨髓)产品。
1998年以来CDRH和CBER两机构前后批准上市了8个组织工程产品,最新的是2016年由CBER审评通过的自体培养的软骨细胞,具体情况如表2所示:

FDA建议实施适用于更广范围的产品监督管理方法,既保证公众健康,同时又不给产品的改进造成不必要的限制和负担,倾向采用基于产品风险等级的分类管理方法【5】,在这一点上与我国的监管原则是一致的。
五、组织工程医疗产品监管的进一步需要
原国家食品药品监督管理局2009年发布了第16号通告《关于药械组合产品注册有关事宜的通告》,内容涉及药械组合产品的审评协调机制。鉴于含活细胞和生物活性成分的组织工程产品的特殊性,以及器械监管法规和药品监管法规存在的差异性,因此需要建立起涵盖质量体系要求、非临床与临床试验要求等在内的全面的注册管理协调机制,促进组织工程科学技术进一步产业化以造福人类的进程。
参考文献:
[1] Toso C. Factors predicting survival after post-transplant hepatocellular carcinoma recurrence
[J]. Hepatobiliary Pancreat Sci, 2013, 20(3):342-347.
[2] Soto-Gutierrez A. Perspectives on wholeorgan assembly: moving toward transplantation on demand [J]. Clin Invest, 2012, 122(11):3817-3823.
[3] 韩倩倩,基因治疗产品、细胞治疗产品和组织工程产品在欧盟的监管[J]. Journal of Tissue Engineering and Reconstructive Surgery,October 2014, Vol.10 No.5
[4] 国食药监械[2007]762 号《关于发布组织工程医疗产品研究及申报相关要求的通告》
[5] 奚延斐, 组织工程医疗产品监督管理与标准研究[J]. Chinese J Reparative and Reconstructive Surgery. 2003. Vol 17(6)
审评三部 张书培 史新立 供稿

评论区