原文:https://www.cmde.org.cn/splt/ltwz/ltwy/20231215094629131.html
发布时间:2023-12-15
版权归属原文(中国器审 2023-12-14)
一、前言
增材制造(俗称3D打印)是一种材料累加的制造技术,该技术实现了制造从等材、减材到增材的重大转变。在医疗领域,增材制造技术是实现个性化医疗器械的重要技术手段,已率先在骨科、口腔领域得到应用,实现了从“削足适履”到“量体裁衣”的转变[1]。十三五期间,在国家政策的大力扶持下,增材制造技术发展迅速,尤其在医用增材制造领域,我国医用增材制造技术已由跟跑、并跑,进入领跑新时代,将产生增长逾数百亿的经济拉动效应。然而医用增材制造技术也存在一些现实问题,比如基础研究井喷式发展,但相关的转化路径不明确,个性化精准医疗的应用与医疗卫生健康发展需求难以匹配的矛盾突出,亟需在监管层面进行制度创新,建立基础研究向产业转化的高速路径。本文针对我国医用增材制造监管体系的建设思路提出相关思考,并梳理相关监管成果。
二、我国医用增材制造监管体系建设背景
十三五期间,我国国务院、工信部、发改委、科技部、财政部、市场管理总局等多部门推出系列支持增材制造发展的政策文件,其中,科技部在“增材制造与激光制造”、“生物医用材料研发与组织器官修复替代”重点专项中,针对医用增材制造技术也是发布了多项国家重点研发计划。在国家各项政策的扶持下,我国增材制造产业的基础研究愈发成熟,部分技术已经开展相关临床试验,增材制造医疗器械转化时机日趋成熟。但在实际转化过程却遇到了难题,当时我国没有建立医用增材制造相关的监管体系,转化路径及监管相关的标准或指导文件均缺乏,导致科技创新转化遇到瓶颈,亟需在监管层面进行制度创新。
十三五期间,国家药监局依托多个科研项目,开始了医用增材制造监管体系的探索。2018年,在十三五国家重点研发计划-《新型医用金属材料及植入器械产品标准及其审评科学基础研究》等项目支持下,我国以金属增材制造监管为着力点,开展医用增材制造监管体系研究。2019年,国家药监局依托第一批监管科学重点项目-《医疗器械新材料监管科学研究》,以聚醚醚酮增材制造监管为着力点,持续推进医用增材制造监管体系研究。通过开展相关监管研究,形成了我国医用增材制造监管体系的雏形。
三、我国医用增材制造监管体系建设思路及成果
在医用增材制造领域,业界针对个性化医疗器械的监管也做了较多思考[2,3],我们认为监管体系建设的核心在于制度创新,要基于医用增材制造产业发展现状并预判发展趋势,通过建立系统化的医用增材制造监管体系,实现监管制度和发展相伴行,并实现中国医用增材制造技术全球引领的新格局。目前,我国已初步建立了系统化的医用增材制造监管体系,概括起来讲,主要由法规体系、标准体系、导则体系及产品体系四个方面构成。接下来将针对每部分介绍其建设过程及相关成果。
(一)法规体系
增材制造技术既可以制造标准化产品,也可以制造个性化定制产品,标准化产品按照现行的注册管理模式进行注册或备案审批即可,但个性化定制产品因为有其特殊性,比如主要用于诊断治疗罕见特殊病损情况,预期使用人数极少,没有足够的人群样本开展临床试验;我国已上市产品难以满足临床需求;由临床医生提出,为满足特殊临床需求而设计生产,对医护人员有特殊要求;用于某一特定患者,没有固定的尺寸形状。基于增材制造个性化定制医疗器械以上特点,其难以通过现行注册管理模式进行审批,迫切需要建立定制式医疗器械的监管模式。
在探索我国个性化定制医疗器械监管模式的过程中,首先了解了国际上不同国家对于定制式医疗器械的监管模式,吴静等在《国内外定制式增材制造医疗器械监管法规概述及对行业发展的思考》[4]中总结了美国、欧盟、澳大利亚、加拿大等国家在定制式医疗器械监管上的研究情况。纵观上述已建立定制式医疗器械监管法规及注册体系的国家,均给出了定制式医疗器械的定义,且加强了对医护人员的监管要求。关于定制式医疗器械的上市途径,各个国家的监管模式不尽相同,欧盟和加拿大要求风险等级高的定制式医疗器械需取得上市许可,而美国和澳大利亚目前对于定制式医疗器械则是走的豁免路径。
我国在制定个性化定制医疗器械监管模式的过程中,除了借鉴国外的监管经验,主要依据当时的《医疗器械监督管理条例》和《医疗器械注册管理办法》这两部法规文件,同时结合个性化定制医疗器械的特有属性,探索适用于我国国情的个性化定制医疗器械监管模式。2019年,国家药监局和国家卫生健康委发布了《定制式医疗器械监督管理规定(试行)》(以下简称“定制法规”),明确了我国个性化定制医疗器械的监管模式[5]。至此,定制法规与《医疗器械监督管理条例》及《医疗器械注册管理办法》共同构成了我国医用增材制造监管体系中的法规体系。
定制法规明确了个性化医疗器械包括定制式医疗器械和患者匹配式医疗器械,并给出了这两种医疗器械的定义,明确了定制式医疗器械实行上市前备案管理,当定制式医疗器械临床使用病例数及前期研究能够达到上市前审批要求时,应当按照相应的注册法规要求申报注册或者办理备案。定制法规中明确了生产企业和医疗机构作为共同备案人,向医疗器械生产企业所在地省、自治区、直辖市药品监管部门进行备案,并要求研制、生产符合医疗器械生产质量管理规范及相关附录要求,还应当满足特殊要求,包括医工交互的人员、设计开发、质量控制及追溯管理方面的要求。通过对生产企业及医疗机构两个备案人加强监管以保证定制式医疗器械的安全有效。
可以说,定制法规的出台对于医用增材制造产业的发展具有里程碑的意义,我国从监管制度层面实现了医用增材制造技术的开拓创新。
(二)标准体系
医疗器械标准是在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一的技术要求,是行业共同遵守和参考的技术规范[6]。标准体系是一定范围内的标准按其内在联系形成的有机整体,是按照一定的结构进行逻辑组合,而不是杂乱无序的堆积。医疗器械标准是保证医疗器械安全和有效的重要组成部分。我们也常说“标准决定质量,有什么样的标准就有什么样的质量,只有高标准才有高质量”,足以体现标准对于产业创新发展的重要性。但在2019年之前,我国尚未建立医用增材制造相关的标准,行业发展水平参差不齐,迫切需要建立支撑医用增材制造技术快速发展的标准体系。
我国医用增材制造标准体系的建设过程与医疗器械标准化改革进程相伴随。在十三五之前,行业对于医疗器械标准的采用通常主要聚焦在政府主导的国家标准、行业标准上。在十三五期间,我国医疗器械标准化改革进程加快,其中一项重要举措就是培育和发展团体标准,鼓励具有相应能力的学会、协会、商会、联合会等社会组织和产业技术联盟共同制定满足市场和创新需要的标准,供市场自愿选用,增加标准的有效供给[7],自此开启了团体标准的发展之路。团体标准因其本身所具有的市场基因,与市场主体的利益一致性,既可避免制定出的标准与市场脱节,又可加快标准制定速度,增加标准的有效供给,解决无标生产的问题,促进行业发展。同时,团体标准制定的主体是行业内具备相应标准化能力的专业组织,并按照规范流程制定,其制定的团体标准,可保护技术创新成果,提高产业准入门槛,增强行业竞争力,激发创新积极性,支撑创新驱动。
在医疗器械标准化改革的背景之下,我们医用增材制造标准体系建设的总体思路是建立政府主导的行业标准与市场主导的团体标准协调配套、协同发展的新型标准体系。目前,我国已建立较为完善的医用增材制造标准体系(如图1所示),标准体系涵盖了原材料、工艺验证方法、设备、数据传输、风险管理、产品等不同层面,关注了医用增材制造技术全生命周期质量控制。截止2023年11月,我国已制定并发布的医用增材制造相关标准包括8项行业标准和45项团体标准。标准体系的建立极大的丰富了我国医用增材制造技术规范,推动了行业技术水平的提升。
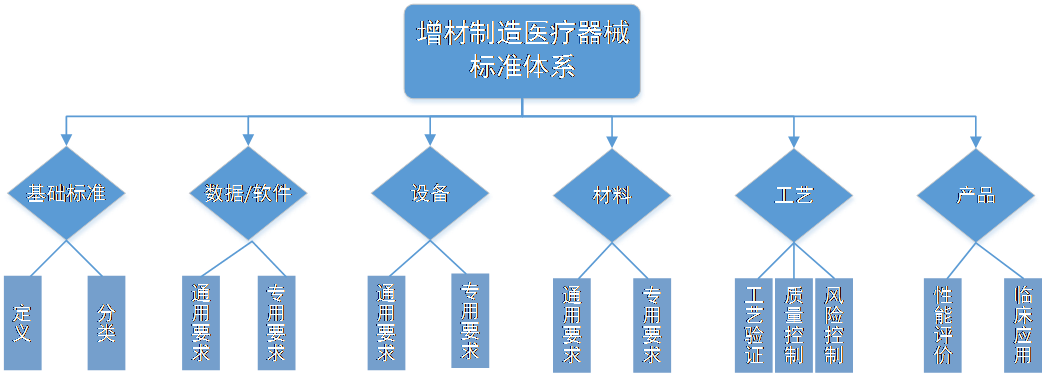
图1 医用增材制造标准体系框架
(三)导则体系
医用增材制造的导则体系也可称之为评价体系,是医用增材制造相关的指导原则的集合,也是监管科学研究重要内容与成果转化的重要载体,以医用增材制造科研和临床应用研究优势领域为着力点,探索具有特色的监管新方法、新标准和新工具,和符合医用增材制造新技术科研转化和临床应用特点的转化路径。指导原则相比法规和标准,其具有专用性,可聚焦于产品性能评价三新的推出,将科研成果应用于行业技术水平提升。同时也具有灵活性,既可以仅进行技术审评内容指导,也可以进行监管模式的探索。
我国在医用增材制造导则体系的建设过程中,从导则编制方式、协作模式及评价思路等方面均进行了积极探索。在导则制定过程中,我国药监局组织医用增材制造领域优势单位进行联合攻关,产-学-研-医-检-政协同合作,基于风险精准控制的理念,以风险识别、风险控制为核心,贯穿医疗器械全生命周期,涵盖了设计、研制、生产、检测、注册上市到临床应用等各个环节。在风险可控的前提下,优化性能评价要求,注重设计输入和审评前置,加强与事中事后监管相协同和全生命周期风险防控,把握医用增材制造的本质规律,实现监管思维模式和理论制度层面的创新。
医用增材制造导则体系的构建不同于常规指导原则,其创新性及优势主要体现在以下几个方面:首先,此类导则属于具有前瞻性的新材料、新工艺应用范畴,填补了监管空白。导则制定过程中需要监管机构与产业、高等院校、科研院所等单位协同创新,实现多维度优势互补,识别增材制造相关风险并进行控制。其次,以指导原则制定为着力点,探索更适合医用增材制造产品的监管模式,深化监管科学研究,助推医用增材制造产品科学监管。再次,通过前瞻性导则的制定,助力评价体系的完善和监管能力的提升,促进医用增材制造领域科研成果转化和产业健康快速发展,更好满足医用增材制造产品临床使用的安全性、有效性和可及性需求。目前,国家药监局已发布10项医用增材制造相关的指导原则(如表1所示),基本覆盖了从原材料、工艺质控、医工交互到成品等各个方面,为医用增材制造技术的基础研究及成果转化提供了技术支撑。

表1 我国已建立的医用增材制造相关指导原则
(四)产品体系
研发是转化的基础,转化是研发的升华和社会实现,二者共同构成了转化科学。我国医用增材制造监管体系建设的目标是推动我国医用增材制造监管制度的创新引领,实现产业的创新发展。因此,产品体系也是我国医用增材制造监管体系的重要组成部分。在推动产业转化之初,我国在植入物领域选择了骨科、口腔植入器械为代表,非植入物领域选择了辅助器械为代表,率先实现创新发展,其他医疗领域跟进。当前我国医用增材制造产品转化数量逐年递增,快速进入到临床应用阶段,极大的满足了患者的特定临床需求。随着转化科学的规律不断被揭示,先进领域的监管模式不断被引入,我国已初步建立了产品转化体系,主要体现在以下两个方面:第一,通过建立科学转化便捷路径,实现了产品仿制向自主研发转变,目前我国部分医用增材制造技术已进入全球领跑阶段,医用增材制造领域实现了国产器械主导发展的历史新格局;第二,在法规体系、标准体系及导则体系的不断完善下,我国逐步建立起医用增材制造产品的科学转化便捷路径,产业转化效率大幅度提升,注册申报产品不断增加。据不完全统计,在骨科植入物领域,截止2023年10月,我国已获批注册的三类增材制造植入医疗器械有40个左右,定制备案的三类增材制造植入医疗器械已超过100个,大大推动了医用增材制造技术的临床应用。
四、总结与展望
我国医用增材制造技术发展迅速,未来医用增材制造监管体系仍待在以下几个方面持续完善:依托关键技术联合攻关的新型机制,推进生物3D打印等关键核心技术突破和成果转化;通过持续开展监管科学研究,加强新工具、新标准和新方法的构建,为技术发展提供技术支撑,打造科研成果向临床应用转化的便捷路径;以增材制造医疗器械高质量发展为契机,坚定创新自信,发挥比较优势,把制度优势转化为医疗器械行业治理效能,形成行业治理能力现代化的典型示范;持续打造政府监管、社会协同、全发展链参与的共享共治监管新模式,系统性、主动性激活基础研究的活力和成果转化动力,为实现技术创新和成果转化应用提供技术支撑。
参考文献:
[1]欧阳安.增材制造从产业培育步入推广应用新阶段—《增材制造产业发展行动计划(2017-2020年)》解析[J].中国机械工程,2018,(23):2895-2897.
[2]李涤尘,孙畅宁. 建立并完善增材制造医疗器械监管科学体系[N].中国医药报,2021-07-13.
[3]闵玥,刘斌.个性化医疗器械监管体系持续完善[N].中国医药报,2019-09-03.
[4]吴静,刘斌.国内外定制式增材制造医疗器械监管法规概述及对行业发展的思考[J].生物骨科材料与临床研究,2020,(5):65-70.
[5]国家药监局 国家卫生健康委关于发布定制式医疗器械监督管理规定(试行)的公告(2019年 第53号)[EB/OL]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20190704160701585.html.
[6]医疗器械标准管理办法[J].中华人民共和国国务院公报,2017(28):54-58.
[7]王晶. 团体标准的构建与发展[C]//中国标准化协会.第十四届中国标准化论坛论文集.《中国学术期刊(光盘版)》电子杂志社有限公司,2017:4.
器械大湾区分中心 高进涛 韩丹 丁金聚 刘斌 供稿

评论区